Bakgrunn
Prostatakreft er den vanligste kreftformen blant menn i Norge. Årlig rapporteres drøyt 5000 nye tilfeller, noe som er om lag en tredjedel av alle kreftdiagnoser hos norske menn, og knapt 1000 menn dør årlig som en konsekvens av sykdommen. Prostatakreft er, i likhet med de fleste krefttyper, assosiert med stigende alder. Medianalder for diagnose er 69 år, og 12.5% av norske menn vil få diagnosen før 75 år års alder. Prostatakreft er avhengig av androgen-reseptor (AR) aktivitet, og mye av behandlingen angriper nettopp AR aksen. For en del av pasientene er imidlertid ikke dette tilstrekkelig, og en del utvikler resistens mot slik behandling. Disse pasientene representerer en kohort med kastraksjonsresistent prostatakreft hvor behandlingsmulighetene er begrenset.
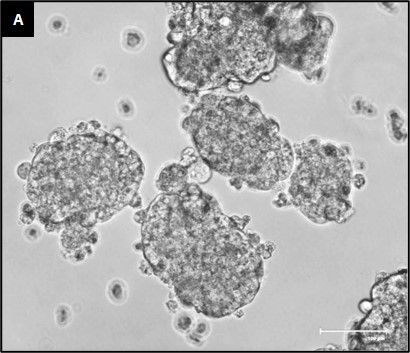
Datamodellering predikerer en viktig rolle for spesielt 6-metyladenosin (m6A) i utvikling av prostatakreft, foreløpig uten at de molekylære mekanismene er kartlagt. Foreløpige resultater fra gruppen vår viser at dersom vi reduserer mengden m6A i prostatakreftceller, så slutter de å vokse. Tilsynelatende skjer dette via en DNA:RNA struktur, en såkalt R-slynge, vi tror kan representere en mekanisme for helt ny behandling. Prosjektet er et samarbeid mellom basalforskere på laboratoriet og urologer i klinikken. Vi bruker kreftvev fra pasienter til å etablere organoider i studiene våre. Organoider er «mikrosvulster» som vokser i laboratoriet, og som etterligner oppførselen til den originale svulsten (Fig. A).
Betydningen av RNA modifikasjoner, f eks m6A, i kreftutvikling er ikke kjent, men man vet at m6A er den mest utbredte RNA modifikasjonen i mRNA. Det finnes et såkalt «skrive-proteinkompleks» som inneholder RBM15, WTAP, METTL3 og METTL14 (Fig B, venstre panel) som setter på m6A på riktige steder.
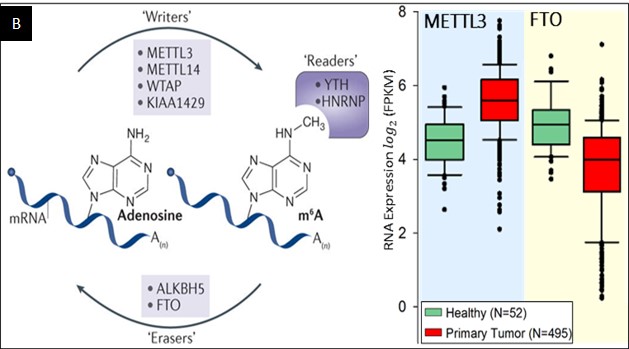
METTL3 er metyltransferasen ansvarlig for selve metyleringen, RPM15 kopler sammen proteinkomplekset med mRNAet, WTAP er et adaptormolekyl som sikrer koplingen mellom RMP15 og METTL3 mens METTL14 snur mRNA substratet på riktig måte. Det finnes også proteiner som fjerner m6A, såkalte «viske proteiner» eller demetylaser. ALKBH5 og FTO er slike proteiner (Fig B, høyre panel). Sist, men ikke minst, det finnes «lese proteiner» f eks YTHDF1, 2 og 3 som effektuerer betydningen av m6A mønsteret og koordinerer mRNA spleising, degradering eller påvirker translasjonen. Helt nylig har man funnet at m6A spiller en sentral rolle i dannelsen av DNA:RNA strukturer, såkalte R-slynger. Disse R-slyngene er strukturer som dannes ved transkripsjon av RNA. RNA molekylet som syntetiseres hybridiserer tilbake på DNA tråden den leses av fra. På denne måten oppstår også et lite strekk av enkelttrådet DNA (Fig C.).
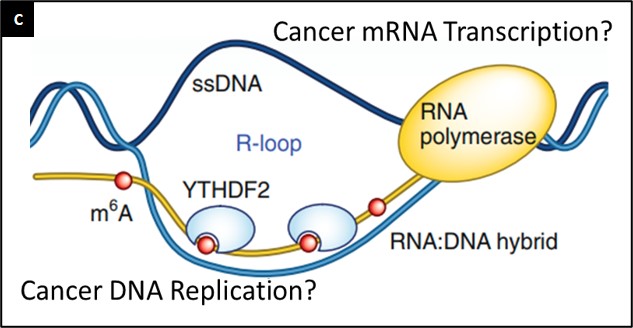
R-slynger er viktige ved transkripssjonstart og slutt, ved replikasjon, for å bevare telomer lengde og ved modning av immunapparatet. De kan imidlertid også indusere DNA skade og blokkere for DNA reparasjon, og derfor bidra til genominstabilitet og kreft generelt, og prostatakreft spesielt. Den eksakte betydningen av m6A i dannelsen av R-slynger er ukjent. Fokus for vårt prosjekt å kartlegge dette med tanke på å utvikle ny behandling for prostatakreft.
Problemstillinger
For å utvikle nye medikamenter til kreftbehandling er det avgjørende med en detaljert forståelse av mekanismene som driver kreftutviklingen. Dette oppnår man best ved å studere en modell som ligger så tett opp til pasienten som mulig. Vi vil studere m6A, og betydningen av R-slyngene, i en organoid modell etablert fra kreftceller hentet fra pasienter med prostatakreft. Målet vårt er å utvikle ny og individualisert behandling for sykdommen.
Mål og metode
- Vi vil karakterisere effektene av å redusere mengden m6A i organoider etablert fra pasienter med sykdom på ulikt stadium. Avansert enkelt-celle RNA sekvensering vil avdekke hvordan ulike svulster responderer på dette.
- Biokjemiske og cellebiologiske metoder vil avdekke hvordan reduksjon av m6A påvirker dannelsen, mengden og lokalisasjonen av R-slynger, og hva dette betyr for kreftcelle overlevelse og oppførsel.
- Nøkkelspørsmål er: Hvilken betydning har m6A fordeling og R-slynger for utvikling og progresjon av prostatakreft? Hvilke cellulære prosesser er regulert av disse strukturene? På hvilken måte (mis)bruker kreftcellene m6A maskineriet for å påvirke dannelsen av R-slynger?
Studentens arbeidsoppgaver
Vi søker etter en motivert medisinstudent som ønsker å lære basal laboratorieforskning (immunocytokjemi, western blotting, PCR) og avanserte biokjemiske- og molekylære metoder (organoid- og cellearbeid, enkel-celle RNA sekvensering og ulike varianter av immunfelling før sekvensering). Interesse for urologi og urologisk kirurgi vil være en fordel, og det vil bli mulighet for å delta i utredning og oppfølging av pasienter med prostatakreft, herunder uthenting biopsimateriale til etablering av organoider i kultur.
Om forskningsmiljøet
Sammen med gruppen til Professor Hilde Loge Nilsen (Seksjonsleder, Klinikk for Laboratoriemedisin/KLM) har vi betydelig ekspertise i enkel-celle analyser, biokjemi, molekylær- og cellebiologi. Vi har også et tett samarbeid med urologer i klinikken ved Bærum sykehus. Til sammen spenner prosjektet vårt fra direkte pasientkontakt i klinikken og til avansert molekylær basalforskning. Prosjektet gir en reell mulighet for å delta i utvikling av ny kreftbehandling, og vil være en unik mulighet for en dedikert medisinstudent til å skaffe seg et fundament og en posisjon i kreftforskning allerede tidlig i karrieren.
Veiledning:
Hovedveileder: Dr. Adam Filipczyk
Medveileder: Professor Hilde Loge Nilsen
Medveileder: Dr. Rune Ougland