Bakgrunn
Moderne diagnostiske undersøkelser i pasienter med antatt arvelige sykdommer benytter i våre dager sekvensering av hele arvestoffet (genomundersøkelser) i blodprøver fra pasientene. Imidlertid, blir som oftest kun data fra gener som allerede er kjent for å være assosiert med sykdommer analysert. Vanligvis resulterer dette i en molekylær diagnose for mindre enn halvparten av de undersøkte pasientene. Dette understreker ikke bare det sterke behovet for forbedrede diagnostiske tilbud til disse pasientene, men synliggjør også begrensningene i vår kunnskap om disse sykdommene.
Problemstillinger
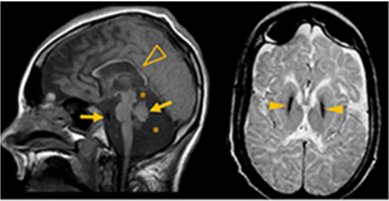
I vårt prosjekt rekrutterer vi pasienter med nevrologiske sykdommer med debut i barnealder og som ikke har fått en molekylær diagnose etter diagnostiske genomundersøkelser. Det er svært sannsynlig at mutasjoner i enkeltgener er årsak til sykdommene i disse pasientene idet de fleste har et progressivt sykdomsforløp, metabolske avvik, affiserte søsken og/eller beslektede foreldre. Dessuten har ikke-genetiske årsaker, slik som infeksjon, traume eller hypoksi, blitt ekskludert. De fleste av pasientene har også funn ved billeddiagnostikk av hjernen (Et eksempel på MR av hjernen i en av pasientene er vist som eksempel i Figur 1).
I prosjektet analyserer vi data fra hele genomet, dvs de mer enn 15 000 genene som ikke tidligere har vært vist assosiert med sykdommer, samt de 98% av genomet som ikke koder for proteiner (ikke-kodene DNA). Vi benytter også globale analyser av genuttrykk, RNA-sekvensering (RNA-seq), en metode som for eksempel kan påvise feil i spleiseprosessen eller endret transkriptnivå som resultat av mutasjoner i ikke-kodende DNA. Effekten av antatt sykdomsgivende genetiske varianter undersøkes videre i cellelinjer, celler fra pasientene og i modellorganismer, primært sebrafisk. I tillegg til å påvise den molekylære diagnosen i mange av de inkluderte pasientene, avdekker vi viktig ny humanbiologisk kunnskap igjennom karakteriseringen av nye sammenhenger mellom gendefekter og deres cellefysiologiske effekter, og videre hvordan disse gir opphav til de kliniske utslagene i pasientene.
Mål og metode
- For å identifisere de molekylære årsakene til den enkelte pasients sykdom, analyserer vi alle gener i genomdata fra pasienter med alvorlige nevrologiske sykdommer.
- Vi analyserer også det globale genuttrykket i celler fra pasientene ved RNA-sekvensering (RNA-seq)
- For å studere strukturelle og funksjonelle defekter forårsaket av de identifiserte mutasjonene, studerer vi fibroblaster fra pasientene og vi manipulerer genuttrykk i cellelinjer (CRISPR/CAS, RNAi og bruk av ekspresjonskonstrukter).
- For å identifisere flere pasienter med mutasjoner i genene vi studerer, benytter vi databasen GeneMatcher.org, og våre internasjonale samarbeidspartnere screener våre kandidatgener i sine pasientkohorter.
- For å studere virkningen av potensielt sykdomsfremkallende genetiske varianter, gjennomfører vi manipulasjon av genuttrykket til de tilsvarende genene hos sebrafisk og vurderer hvordan dette påvirker utviklingen av hjernen i sebrafiskembryo. I enkelte tilfeller følger vi også utviklingen i CRISPR/CAS-muterte sebrafisk-modeller frem til voksne individer for å undersøke sammenhengen mellom identifiserte mutasjoner og deres kliniske konsekvenser. Det videre arbeidet med CRISPR/CAS-modeller vil strekke seg over en tidsperiode som går utover rammene av et enkelt forskerlinjeprosjekt.
Studentens arbeidsoppgaver
Målet med forskerlinjeprosjektet er å beskrive sammenhengen mellom en genetisk defekt som ikke tidligere er beskrevet, påvise effekten denne har på cellens fysiologi og oppnå kunnskap om hvordan de kliniske utslagene i pasientene oppstår.
Avhengig av studentens interesser, vil forskerlinjeprosjektet kunne bidra i en eller flere av de følgende arbeidspakkene innen våre prosjekter:
- Analysere genomdata og RNA-seq data: På grunn av det høye antallet genetiske varianter som påvises ved denne tilnærmingen, er sammenligningen av data fra pasient og foreldre viktig for de bioinformatiske analysene. Studenten vil få opplæring i data-analyse og vil utføre dette arbeidet i nært samarbeid med medlemmer av forskningsgruppen.
- Utforske hypoteser om de genetiske variantenes molekylære konsekvenser: Gjennomføre in vitro-eksperimenter i celler etablert fra pasientene og/eller manipulere genuttrykk i etablerte cellelinjer.
- Studere funn i potensielle nye sykdomsgener i sebrafiskembryo.
- Systematisere klinisk informasjon og bidra i tolkningen av resultater fra kliniske, biokjemiske, nevrofysiologiske og nevroimaging-undersøkelser for å opparbeide en fullstendig beskrivelse av pasientens kliniske fenotype.
Om forskningsmiljøet
Prosjektet gjennomføres i prof. E. Frengens forskningsgruppe ved Avdeling for medisinsk genetikk (AMG, UiO/OUS). Studenten vil bli veiledet av Frengen og Dr. Misceo (co-PI), og jobbe tett sammen med medlemmene i forskningsgruppen: PhD-, MSc- og forskerlinjestudenter og en forskningstekniker.
Avanserte cellebiologiske analyser, inkludert “state-of-the-art imaging” gjennomføres i samarbeid med gruppen til Professor Cinzia Progida (Institutt for biovitenskap, UiO). Zebrafiskarbeid gjennomføres i samarbeid med gruppen til Professor Camila Esguerra (Centre for Molecular Medicine, UiO).
Den kliniske sammenstillingen og evalueringen av pasientene utføres av klinikere ved OUS, og videre kliniske undersøkelser blir koordinert av dem. I tillegg er det etablert samarbeid med verdensledende eksperter på sjeldne nevrologiske sykdommer.
AMG har et godt læringsmiljø. For tiden jobber mer enn 30 P.docs, PhD-, MSc- og forskerlinjestudenter ved AMG. Vårt miljø er tverrfaglig, internasjonalt, ungt og ambisiøst. Vi ser frem til å veilede nye studenter.