Bakgrunn
Ca2+ starter den synaptiske signaloverføring
Hjernens synapser er ørsmå strukturer som er spesialisert for kommunikasjon. Ved ankomst av et aksjonspotensial til enden av axonet, til den presynaptiske terminalen, åpner spenningsstyrte ionekanaler for en innstrømning av Ca2+ som deretter igangsetter eksocytose av transmitter-holdige vesikler. Transmittermolekylene binder seg til postsynaptiske reseptorer, som bringer signalet videre til mottagercellen. Synaptisk plastisitet blir ofte definert som en endring i synaptisk styrke, målt elektrofysiologisk ved det eksitatoriske postsynaptiske potensialet (Bliss&Gardner-Medwin, J Physiol, 1973). Denne styrken er avhengig av den postsynaptiske reseptorkonsentrasjonen. Synaptisk plastisitet regnes som det biologiske grunnlaget for hukommelse og læring og er derfor av vital betydning for alt menneskeliv.
To kilder til Ca2+ er kjent
Selv om det normalt registreres postsynaptisk, er presynaptiske mekanismer også involvert. I både pre- og postsynaptiske plastisitetsmekanismer spiller Ca2+ en avgjørende rolle som en intracellulær budbringer (Mateos-Aparicio&Rodriguez-Moreno, Adv Exp Med Biol, 2020; Sanderson et al., Front Neural Circuits, 2020). I følge lærebøker er det to kilder til Ca2+ i presynaptiske terminalene: 1. Det ekstracellulære rommet, som Ca2+ strømmer inn fra gjennom spennings-styrte Ca2+-kanaler, og 2. glatt endoplasmatisk retikulum (SER).
Vi skal påvise en tredje kilde for Ca2+
Vi har til hensikt å endre dette bildet. Problemet med SER er at det er svært lite av det i presynaptiske terminaler. I klassiske elektronmikroskopiske bilder ses SER sjelden, om noen gang, i seksjoner av presynaptiske terminaler (Harris&Stevens, J Neurosci, 1989). Noen få nyere studier med nye avbildningsteknikker har vist tilstedeværelse av SER i terminaler (Wu et al., PNAS, 2017), men selv i disse tilfellene er SER relativt liten, og plassert på baksiden av terminalen, langt fra den aktive sonen der vesikkeleksocytose av transmitter finner sted.
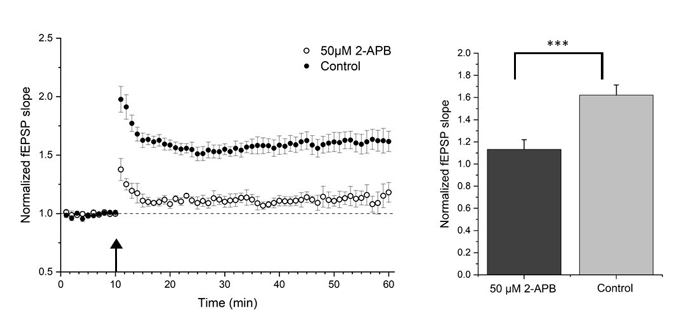
Vi har nylig generert foreløpige eksperimentelle data som indikerer at de synaptiske vesiklene selv har høye konsentrasjoner av Ca2+, at disse vesiklene er utstyrt med ligand-styrte Ca2+-kanaler, kalt inositol 1,4,5-trisphosphate receptor type 1 (IP3R1), og at konsentrasjonen av presynaptisk, vesikulær IP3R1 øker med ca. 60 % etter induksjon av langtidspotensiering (LTP), og til slutt, at LTP i seg selv er betydelig redusert i hippocampus-skiver som er behandlet med IP3R1-antagonisten 2- APB (se figur).
Etter vår publisering av lokalisering av IP3R1 på presynaptiske vesikler, har ekspresjon av IP3R1 (Itpr1) i synaptosomer blitt vist av andre ved bruk av væskekromatografi-massespektrometrianalyse (Gulyassy et al., Amino Acids, 2020) og på synaptiske vesikler ved bruk av tverrbindende massespektrometri (Wittig et al., Nat Commun, 2021; Taoufiq et al., PNAS, 2020).
Grunnleggende ny forståelse av regulering av synaptisk signalering
Disse funnene har potensiale til å fremkalle en grunnleggende forandring i vår forståelse av hvordan synaptisk signalering blir regulert. Ingen har noen gang vist at de presynaptiske vesiklene i seg selv kan spille en sentral rolle i å regulere Ca2+-konsentrasjoner. Vi tror at Ca2+ fra en enkelt vesikkel, som strømmer ut gjennom IP3R1-kanalen, kan binde seg til denne vesikkelens egne synaptotagmin-proteiner på utsiden. Synaptotagmin er en kjent som synapsenes «master switch» og er avhengig av nettopp Ca2+ for å igangsette vesikkel-eksocytosen, dvs frigjøring av transmitter ut i den synaptisk spalten.
Problemstilling
Forskerlinjeprosjektet har følgende hovedhypotese:
- Synaptiske vesikler inneholder høy konsentrasjon av Ca2+, som kan slippes ut i cytosol rundt den enkelte vesikkel for å øke sannsynligheten for exocytose av transmitter.
Mål og metode
Delmål 1: Dokumentere at synaptiske vesikler inneholder IP3R1 og høye konsentrasjoner av Ca2+
Metoder:
- Påvisning av vesikulær Ca2+ ved bruk av Fluo-4 AM i en ren synaptisk vesikkel-fraksjon. Fluo-4 AM fluoreserer i nærvær av Ca2+
- Påvise ved hjelp av immunofluoresens av IP3R1, synaptophysin og synaptotagmin på enkelt-vesikler hvor vi samtidig påviser Ca2+ ved hjelp av Fluo-4 AM, i super-resolusjonsmikroskop
- Bekrefte at IP3R1 finnes på vesikler i intakte nerveterminaler vha immunogull-merkning av elektronmikroskopiske snitt.
Delmål 2: Dokumentere at Ca2+ kan frigjøres til cytosol i nerveterminalen fra vesikler gjennom IP3-styrte ionekanaler
- Påvise IP3R1-avhengig frigjøring av Ca2+ fra vesikler, ved hjelp av real-time Fluo-4 AM imaging av isolerte vesikler, etter stimulering med IP3 vs kontroll.
- Påvise IP3R1-avhengige Ca2+-spikes i synapser i intakte hippocampus-nevroner i cellekultur, ved hjelp av «live cell imaging» av kulturer som er stimulert med høy [K+], hvor hippocampus-cellene kommer fra genetisk modifiserte mus som uttrykker GCAMP6.
Studentens arbeidsoppgaver
- Disseksjon av hippocampus fra rotte- og musehjerne
- Elektronmikroskopi av hjernesynapser hos mus
- Immungull-merkning med antistoff mot funksjonelt viktige synapseproteiner
- Avansert statistisk analyse med R
- Isolering av synaptiske vesikler ved hjelp av høy-hastighets sentrifugering
- Superresolusjonsmikroskopi
- Forberede presentasjoner av egne resultater
- Trening i muntlig fremføring av forskning
Om forskningsmiljøet
Svend Davanger er hovedveileder. Han er lege, Dr.Med. professor ved Seksjon for anatomi, Institutt for medisinske basalfag. Medveileder er Suleman Hussain, førsteamanuensis ved Institutt for oral biologi, Odontologisk fakultet. Han har nylig startet eget forskningslaboratorium, i samarbeid med professor Linda Bergersen. Han er også knyttet til forskningsgruppen til hovedveileder. Sammen leder de Laboratorium for synaptisk plastisitet. Davanger er hovedveileder for to leger som er ph.d.-stipendiater. Hussain er hovedveileder for en annen lege som arbeider med ph.d. Gruppen består i tillegg av en lege/tidligere forskerlinjestudent, en forskerlinjestudent, to masterstudenter og en Fulbright scholar fra USA. To laboratorieingeniører er også knyttet til forskningsmiljøet. Vi har gode samarbeid med andre grupper ved UiO, samt universitetene Yale og Stanford i USA. Vi arbeider intenst med forskningsprosjekter knyttet til hjernen og dens funksjoner, men vi legger også vekt på et sosialt miljø utover forskningen.