Anne Simonsen ved IMB ble nettopp tildelt Kong Olav Vs kreftforskningspris. Men man trenger ikke være opptatt av kreft for å finne forskningen hennes interessant.
Gruppen hennes studerer autofagi. Denne cellulære prosessen er interessant for flere forskjellige sykdommer, og som basalforskning gir den nyttig informasjon om cellens indre liv.
Selvspising
Cellens daglige liv fører til avfall av typen ødelagte proteiner, utslitte organeller med mer. En av mekanismene cellene bruker for å bli kvitt dette er autofagi.
Autofagi betyr selvspising, og cellene blir kvitt sitt eget avfallet ved å «spise» det. De etablerer da sin egen miljøstasjon, bryter ned celleavfall og resirkulerer brukbare byggematerialer.
Autofagi forhindrer akkumulering av skadelige stoffer, hjelper cellen å prioritere sentrale funksjoner ved energimangel, og bidrar til energiøkonomisering ved at små byggesteiner brukes om igjen.
Holder deg frisk

– Autofagi holder cellen frisk, forteller Anne Simonsen. – Cellen må sørge for balanse mellom produksjon og nedbrytning, hvis ikke går det galt.
Og det går ikke bare galt for cellen selv. Vi kan bli syke om dette systemet inni cellene våre svikter.
Redusert autofagi fører til avleiringer som igjen kan gi sykdom. Forstyrrelser i autofagi har for eksempel blitt koblet til nevrodegenerative sykdommer som Parkinsons og Alzheimer, men også til kreft. Autofagi kan dessuten bremse infeksjoner, ved å destruere bakterier og virus som befinner seg inni cellene.
På denne måten bidrar en prosess inni cellene dine til at du holder deg frisk.
Intracellulær miljøstasjon
Hvordan danner cellene miljøstasjoner?
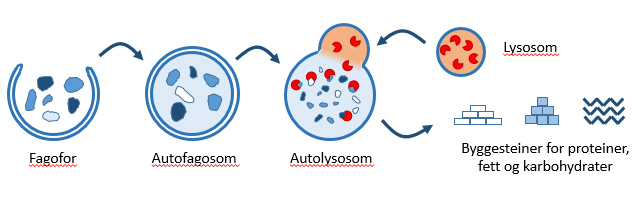
Søppelsekker
Ved hjelp av membraner danner cellen en «søppelsekk». Der samler den alt som skal brytes ned. Den kan enten lage sekker som bare inneholder utvalgte ting, eller den kan lage store sekker med mye forskjellig avfall. Åpne søppelsekker som er i ferd med å få innhold kalles fagoforer. Når de er fulle og har blitt lukket kalles de autofagosomer.
Nedbrytning og sortering har ennå ikke kommet i gang. For dette starter de et samarbeid med en annen av cellens avdelinger, lysosomene. De er spesialister på å bryte ned, cellens egen avdeling for destruksjon. De inneholder enzymer som gjør denne jobben, godt hjulpet av et surt miljø.
Miljøstasjon
Når søppelsekkene fusjonerer med lysosomene får innholdet tilgang til enzymene og det sure miljøet, og innholdet i søppelsekken brytes ned.
Denne miljøstasjonen, autolysosomet, bidrar også til resirkulering. Når fett, karbohydrater og proteiner er brutt ned til mindre byggesteiner, kan en del resirkuleres i nye produkter, eller de kan brukes til å lage energi.
Membraner og proteiner
Anne Simonsens gruppe forsker på dannelsen av fagoforer. Hvordan oppstår de, hvordan samles søpla her og hvilken rolle spiller proteinene i fagoformembranen.
Forskningen deres har nylig ført til artikler i Nature Cell Biology og Developmental Cell.
Anker i membranen
Alf Håkon Lystad har i Nature Cell Biology artikkelen studert et protein kalt ATG16L1.
ATG16L1 er del av et større maskineri som fester en spesiell merkelapp til autofagimembranen.
Merkelappen fungerer som et anker for avfallsprodukter som sorteres til miljøstasjonen. Den er også viktig for rekruttering av andre proteiner som trengs.
Et protein, to varianter
Det finnes to varianter av ATG16L1, alfa og beta, men det har hittil ikke vært påvist noen funksjonell forskjell. Det er en slik forskjell Lystad nå har funnet.
– Vi har identifisert to områder i ATG16L1 som er viktig for binding til fagofor membranen, forteller Lystad. – Betavarianten av proteinet har begge de to områdene, mens alfavarianten bare har ett. Vi har undersøkt hvordan dette påvirker proteinets funksjon, fortsetter han.
Dersom cellen sulter må den prioritere beinhardt. Ved hjelp av autofagi kan den spise litt av seg selv, og på den måten skaffe seg energi. For dette er det første membranbindende området av ATG16L1 helt nødvendig.
Det andre området er normalt ikke påkrevd, men Lystad har vist at under spesielle betingelser gir også dette området et viktig bidrag . Dermed får betavarianten av proteinet en funksjon alfavarianten ikke har.
Fjerner bakterier
Det foregår en evig kamp mellom bakterier og immunforsvaret, men bakterier som ender opp inni cellen slipper ofte unna. Da kan ATG16L1 og autofagien komme til unnsetning.
Inni cellen gjemmer bakteriene seg i en avdeling kalt endosomer. Men de avslører seg selv når de skaper endringer i membranen som omslutter det endosomet de gjemmer seg i. Slike forandringer kan oppdages av ATG16L1. Proteinet kommer inn og fester merkelappen sin på endosomoverflaten, og hele endosomet, med bakterier og alt, brytes ned ved autofagi.
Lystad og medarbeidere fant at begge de to membranbindende områdene i ATG16L1 var viktige for å starte denne mekanismen.
Crohns sykdom
Andre har tidligere påvist mutasjoner i ATG16L1 som er assosiert med Crohns sykdom. En av de kjente mutasjonene ligger rett ved det andre membranbindende området Lystad har studert. Det er fristende å spekulere i om denne mutasjonen påvirker de funksjonene Lystad har observert.
– Dette er noe vi følger opp, forteller Lystad. – Denne Crohns-mutasjonen ligger jo rett ved siden av membran-interaksjons-motivet. Det er sannsynlig at det er en sammenheng mellom motivet og mutasjonen, men hva dette er har vi ikke funnet ut av enda. Men vi har jo våre hypoteser selvsagt, sier han.
Mitofagi
I den andre artikkelen, den i Developmental Cell, har Simonsens forskningsgruppe samarbeidet med Terje Johansen ved Universitetet i Tromsø. Sammen har de studert hvordan autofagi brukes til å bryte ned mitokondriene, en prosess kalt mitofagi.
Mitokondriene er cellens energiverk men de har og mange andre viktige funksjoner i cellene våre. Mitokondriene er livsviktige, men gamle eller ødelagte mitokondrier kan være direkte skadelige. De må derfor elimineres.
Fjerning av gamle mitokondrier er viktig for at for eksempel nerveceller holdes friske. Mutasjoner i mitofagimaskineriet kan kobles til Parkinsons sykdom.
Forskergruppene til Simonsen og Johansen har studert hvilke signaler som starter denne viktige mitofagiprosessen. Hvordan vet autofagimaskineriet hvilke mitokondrier som bør fjernes?
Spis meg
Sammen med Yakubu Abudu i Tromsø har Serhiy Pankiv og Benan John Mathai i Simonsens gruppe identifisert to proteiner (kalt NIPSNAP1 og NIPSNAP2). – Vi ser at de akkumuleres på overflaten av skadde mitokondrier. Der er de viktige for rekruttering av autofagimaskineriet. Dermed er prosessen i gang og mitokondriene blir brutt ned, sier Simonsen.
– NIPSNAP-proteinene fungerer som et slags «spis meg-merkelapp», fortsetter hun.
Sebrafisk med Parkinsons
Simonsens gruppe har samarbeidet med kjernefasilitet for sebrafisk (lenke) i flere år. Så også på NIPSNAP-studiene.
NIPSNAP-proteinene er godt konservert gjennom evolusjonen. Det tyder på at de har en viktig funksjon i cellen, og det gjør det mulig å studere dem i modellorganismer som er ganske så forskjellige fra mennesker.
Benan John Mathai har studert hva som skjer i sebrafish som mangler disse proteinene.
Han så at mitofagiprosessen var redusert i sebrafisklarver uten Nipsnap1 (jepp, skrives med små bokstaver nå når vi er over i fisk).
– Vi fant også at sebrafisklarver uten Nipsnap1 viste tegn på parkinsonisme, forteller Simonsen. – De svømte mindre enn normale larver, og hadde lavere nivå av en type (dopaminerge) nerveceller. Det er ting som tyder på at de også har lavt nivå av signalstoffet dopamin. Disse endringene ser man og hos Parkinsonpasienter, avslutter hun.
Les mer
- Kong Olav Vs Kreftforskningspris til Anne Simonsen
- Autofagi på medisinbloggen
- Orginalartikkel, AG16L1
- Orginalartikkel, NIPSNAP
Kontakt
- Anne Simonsen https://www.med.uio.no/imb/personer/vit/annesi/index.html
- Autofagigruppa https://www.med.uio.no/imb/forskning/grupper/autofagi/index.html
